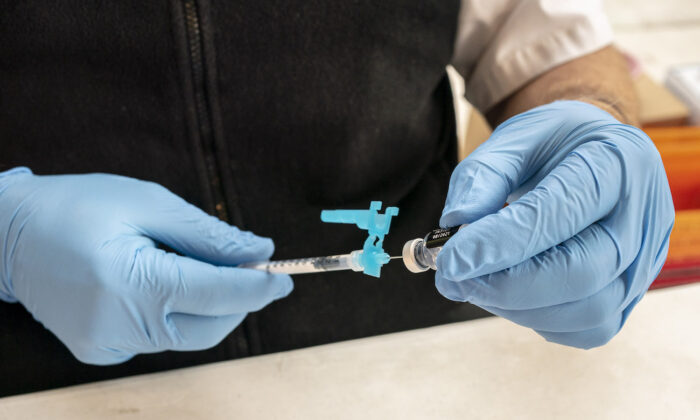
Η Pfizer και η BioNTech ολοκλήρωσαν την αίτηση στον Οργανισμό Τροφίμων και Φαρμάκων (FDA) για την έγκριση επείγουσας χρήσης (EUA) για ένα σχήμα εμβολίου COVID-19 τριών δόσεων για παιδιά ηλικίας 6 μηνών έως 5 ετών.
Η Pfizer ανακοίνωσε την ολοκλήρωση της αίτησης EUA την Τετάρτη, σύμφωνα με πολλά μέσα ενημέρωσης.
Οι εταιρείες ζήτησαν αρχικά από τον FDA EUA τον Φεβρουάριο για ένα σχήμα δύο δόσεων του εμβολίου COVID-19 των 3 μg για την ηλικιακή ομάδα, αλλά ο οργανισμός στις 11 Φεβρουαρίου ανέβαλε την απόφασή του σχετικά με την αίτηση μέχρι να λάβει δεδομένα για τρεις δόσεις. Την ίδια ημέρα, η Pfizer-BioNTech ανακοίνωσε ότι θα καθυστερήσει την ολοκλήρωση της αίτησής της για χορήγηση της άδειας μέχρι να λάβει δεδομένα για την τρίτη δόση.
Η δόση των 3 μg του εμβολίου της Pfizer-BioNTech για την ηλικιακή ομάδα κάτω των 5 ετών είναι το ένα δέκατο της δόσης που λαμβάνουν οι ενήλικες (30 μg) και το ένα τρίτο εκείνης που χορηγείται σε παιδιά ηλικίας 5-11 ετών (10 μg).
Ο FDA έκανε έκτοτε δεκτή την αίτηση επανεξέτασης των δεδομένων από την Pfizer-BioNTech, σύμφωνα ABC News. Ο οργανισμός δήλωσε την Τετάρτη ότι θα επανεξετάσει το αίτημα EUA «το συντομότερο δυνατό χρησιμοποιώντας μια επιστημονικά τεκμηριωμένη προσέγγιση».
Η Pfizer σημείωσε σε ανακοίνωσή της στις 23 Μαΐου ότι έχει συγκεντρώσει «δεδομένα ασφάλειας, ανοσογονικότητας και αποτελεσματικότητας του εμβολίου» από τη δοκιμή Φάσης 2/3. Η δοκιμή έδειξε ότι μια τρίτη δόση 3 μg του εμβολίου COVID-19 της Pfizer-BioNTech «προκάλεσε ισχυρή ανοσολογική απόκριση, με ευνοϊκό προφίλ ασφάλειας παρόμοιο με το εικονικό φάρμακο» σε παιδιά ηλικίας 6 μηνών έως κάτω των 5 ετών, δήλωσε η Pfizer.
Το εμβόλιο ήταν επίσης κατά 80,3% αποτελεσματικό στην πρόληψη των συμπτωμάτων του COVID-19 σύμφωνα με τη μελέτη, δήλωσαν οι εταιρείες. Σημείωσαν ότι το ποσοστό αυτό βασίζεται σε 10 συμπτωματικά περιστατικά COVID-19 «από επτά ημέρες μετά την τρίτη δόση και συσσωρευμένα από τις 29 Απριλίου 2022».
Χρειάζονται τουλάχιστον 21 περιπτώσεις για να προσδιοριστεί επίσημα αν το εμβόλιο είναι αποτελεσματικό. «Τα τελικά δεδομένα για την αποτελεσματικότητα του εμβολίου θα κοινοποιηθούν μόλις είναι διαθέσιμα», ανέφεραν οι εταιρείες.
Στη δοκιμή Φάσης 2/3, μια τρίτη δόση του εμβολίου χορηγήθηκε σε 1.678 παιδιά «τουλάχιστον δύο μήνες μετά τη δεύτερη δόση σε μια εποχή που η Όμικρον ήταν η επικρατούσα μετάλλαξη». Η τρίτη δόση φάνηκε να προκαλεί μια απάντηση αντισωμάτων αρκετή ώστε να πληροί τα κριτήρια του FDA για επείγουσα χρήση του εμβολίου, δήλωσαν οι εταιρείες.
«Τρεις δόσεις 3 μg του εμβολίου COVID-19 της Pfizer-BioNTech ήταν καλά ανεκτές σε αυτή την ηλικιακή ομάδα», πρόσθεσαν. «Η πλειονότητα των ανεπιθύμητων ενεργειών ήταν ήπιες ή μέτριες».
Ο Άλμπερτ Μπουρλά, πρόεδρος και διευθύνων σύμβουλος της Pfizer, δήλωσε ότι η εταιρεία είναι ικανοποιημένη που το εμβόλιο «ήταν καλά ανεκτό και παρήγαγε ισχυρή ανοσολογική απόκριση».
Ο Ουγούρ Σαχίν, διευθύνων σύμβουλος και συνιδρυτής της BioNTech, δήλωσε ότι η μελέτη υποδηλώνει ότι το εμβόλιο «παρέχει στα μικρά παιδιά υψηλό επίπεδο προστασίας έναντι των πρόσφατων στελεχών COVID-19..
Τα παιδιά ηλικίας 5 ετών και κάτω αποτελούν τη μόνη ηλικιακή ομάδα στις Ηνωμένες Πολιτείες που επί του παρόντος δεν είναι επιλέξιμη από τον FDA για οποιοδήποτε εμβόλιο COVID-19.
Μια δημοσκόπηση του Kaiser Family Foundation τον Απρίλιο διαπίστωσε ότι «[ένας στους πέντε γονείς παιδιών κάτω των 5 ετών [18%] είναι πρόθυμοι να εμβολιάσουν το παιδί τους και δηλώνουν ότι θα το κάνουν αμέσως μόλις εγκριθεί το εμβόλιο COVID-19 για την ηλικιακή τους ομάδα».
Ο FDA ανακοίνωσε την Τετάρτη ότι θα πραγματοποιήσει συνεδρίαση στις 15 Ιουνίου για την ανεξάρτητη συμβουλευτική επιτροπή του, τη Συμβουλευτική Επιτροπή Εμβολίων και Συναφών Βιολογικών Προϊόντων, προκειμένου να συζητήσει το αίτημα της Pfizer για χορήγηση άδειας ΕΕ.
Η ίδια επιτροπή στις 15 Ιουνίου θα συζητήσει επίσης την αίτηση EUA της Moderna για το εμβόλιο της εταιρείας, που προορίζεται για άτομα ηλικίας 6 μηνών έως κάτω των 6 ετών.
Η Moderna ζητά έγκριση για ένα σχήμα δύο δόσεων του εμβολίου της, κάθε μία από τις οποίες περιέχει 25 μg, δηλαδή το ένα τέταρτο της δόσης για τα άτομα ηλικίας 12 ετών και άνω.
Η αποτελεσματικότητα του εμβολίου στην πρόληψη της λοίμωξης, συμπεριλαμβανομένης της ασυμπτωματικής και ήπιας λοίμωξης, από τον ιό SARS-CoV-2 για τα άτομα ηλικίας 6 μηνών έως 2 ετών ήταν μόνο 51% και για τα άτομα ηλικίας 2 έως κάτω των 6 ετών ήταν 37%, δήλωσε η Moderna στα τέλη Απριλίου.
Τα εμβόλια της Pfizer-BioNTech και της Moderna βασίζονται αμφότερα στην τεχνολογία mRNA. Τα εμβόλια COVID-19 από αυτές τις εταιρείες έχουν συνδεθεί με φλεγμονές της καρδιάς, συμπεριλαμβανομένης της μυοκαρδίτιδας και της περικαρδίτιδας, σύμφωνα με δεδομένα που συλλέχθηκαν από όλο τον κόσμο.
Οι νεότεροι πληθυσμοί, ιδίως οι νεαροί άνδρες, έχουν παρατηρηθεί ότι εμφανίζουν αυτές τις παθήσεις σε πολύ υψηλότερα από τα αναμενόμενα ποσοστά, σύμφωνα με στοιχεία από το CDC. Έχει αναφερθεί μικρός αριθμός θανάτων από φλεγμονή της καρδιάς μετά το εμβόλιο COVID-19.
Η Λιζ Μούμπερ, παιδίατρος και πρώην ιατρική διευθύντρια του Ινστιτούτου Ερευνών για τον Αυτισμό, δήλωσε σε συνέντευξή της στο Children’s Health Defense ότι η φυσική ανοσία παρέχει πολύ πιο ανθεκτική και ευρύτερη προστασία για τα παιδιά από ό,τι τα εμβόλια.
Είπε επίσης ότι εάν ένα παιδί προσβληθεί από COVID-19, όχι μόνο δεν χρειάζεται το εμβόλιο αλλά μπορεί να διατρέχει μεγαλύτερο κίνδυνο ανεπιθύμητων ενεργειών εάν αναγκαστεί να το κάνει.
«Εάν τα παιδιά δεν χρειάζονται τα εμβόλια, δεν θέλουμε να τους δώσουμε τα εμβόλια επειδή δεν έχουμε μακροπρόθεσμες μελέτες σχετικά με τις παρενέργειες και οι βραχυπρόθεσμες πληροφορίες που έχουμε είναι πραγματικά αρκετά ανησυχητικές για μένα», δήλωσε η Μούμπερ. Ο οικοδεσπότης της συνέντευξης επεσήμανε ότι το ποσοστό επιβίωσης του COVID-19 στα παιδιά είναι 99,98%.
Οι κατασκευαστές εμβολίων έχουν ασυλία από την ευθύνη για τυχόν ανεπιθύμητες ενέργειες -εκτός αν πρόκειται για «εσκεμμένη παράβαση». Οι πάροχοι εμβολίων υποχρεούνται να αναφέρουν τυχόν σοβαρές ανεπιθύμητες ενέργειες ή λάθη στη χορήγηση εμβολίων στο VAERS, που φιλοξενείται από το Υπουργείο Υγείας και Ανθρωπίνων Υπηρεσιών των ΗΠΑ.
Η ομοσπονδιακή κυβέρνηση διαθέτει ένα πρόγραμμα αντίμετρων που μπορεί να αποζημιώσει τα επιλέξιμα άτομα που υφίστανται σοβαρές βλάβες από εγκεκριμένα εμβόλια. Αλλά για να αποδειχθεί κάτι τέτοιο φαίνεται να είναι μια δύσκολη διαδικασία.
Ο Naveen Athrappully και ο Zachary Stieber συνέβαλαν σε αυτό το ρεπορτάζ.